Autori: Beatrice Andrenacci1, Gaia Di Bella2
Affiliazioni:
1Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano, Milano, Italia
2Dipartimento di Pediatria, Ospedale “F. Del Ponte”, Università dell’Insubria, Varese, Italia
I disturbi respiratori del sonno (DRS) sono un insieme di condizioni caratterizzate da anomalie nel pattern respiratorio durante il sonno, associate o meno a desaturazione e/o arousal. La prevalenza dei DRS in Pediatria è compresa tra il 2% e il 5%, con tassi anche maggiori in soggetti ex prematuri, sindromici o con alterazioni del neurosviluppo1. Se non riconosciuti precocemente e adeguatamente trattati, i DRS possono impattare negativamente sullo sviluppo neurocognitivo del bambino e sul suo benessere psicofisico, con potenziale impatto in termini di comportamento, rendimento scolastico, qualità di vita e aumentato rischio di patologie cardio-vascolari2. La diagnosi precoce di tali disturbi è quindi cruciale per ridurne la morbilità a breve e a lungo termine.
La diagnostica dei DRS in Pediatria oggi. La polisonnografia Gold standard diagnostico: metodi e limiti
Attualmente, la polisonnografia (PSG) è considerata il gold standard per la diagnosi della sindrome delle apnee ostruttive del sonno (OSAS) anche nell’età pediatrica. Questo test multicanale consente di valutare numerosi parametri fisiologici come l’attività cerebrale (EEG), l’attività muscolare (EMG), il flusso d’aria, i movimenti respiratori e la saturazione notturna di ossigeno (SpO2), permettendo di identificare e quantificare con precisione gli eventi respiratori. Tuttavia, la PSG è una metodica costosa che richiede risorse e personale specializzato, deve essere condotta in un ambiente clinico controllato ed è spesso poco tollerata dai bambini3.
Alternative semplificate: poligrafia e pulsossimetria
Viste tali difficoltà tecniche, alternative meno invasive e più accessibili come la poligrafia domiciliare e la pulsossimetria notturna offrono una buona alternativa alla PSG, mantenendo una discreta capacità diagnostica. In particolare, la poligrafia domiciliare permette di rilevare parametri essenziali come il flusso d’aria, i movimenti toracici e addominali, la SpO2 notturna e la frequenza cardiaca (FC), pur non fornendo informazioni approfondite sulla stadiazione del sonno. Di contro, la pulsossimetria notturna, con la quale è possibile documentare i valori di SpO2 e FC notturne, è utile soprattutto come strumento di screening specialmente in bambini altrimenti sani con sospetta ipertrofia adeno-tonsillare. Quest’ultima, a differenza della PSG, non permette di discriminare la natura ostruttiva o centrale di eventi desaturanti, potendo risultare talora inconclusiva nel caso di OSAS non desaturanti2.
La diagnostica dei DRS in Pediatria domani: innovazioni e prospettive future
Ad oggi l’American Academy of Sleep Medicine (AASM) ha creato una task force interamente dedicata allo studio del ruolo dell’intelligenza artificiale (AI) nella diagnostica e nel monitoraggio dei DRS. L’integrazione di nuove tecnologie wireless, che uniscano l’utilizzo di dispositivi indossabili specificatamente progettati per l’età pediatrica ad algoritmi AI automatizzati, offre un enorme potenziale nel campo dei DRS, con buona accuratezza diagnostica, miglior tollerabilità per i piccoli pazienti e netta riduzione di costi e tempi di refertazione. Inoltre, la minor invasività e maggior rapidità di analisi di tali dispositivi potrebbe fornire dati più rappresentativi del sonno abituale del bambino, superando la variabilità notturna “night to night” che può inficiare i classici studi del sonno condotti su singola notte4.
L’AI e i nuovi strumenti diagnostici remoti dei disturbi respiratori del sonno
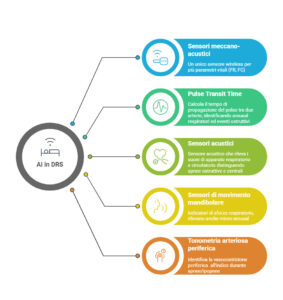
Ad oggi le tecnologie più promettenti sono costituite da sensori meccano-acustici transcutanei; dispositivi per la valutazione del pulse transite time (PTT); dispositivi indossabili che sfruttano principi di diagnosi acustica; dispositivi per il rilevamento di movimenti mandibolari; e dispositivi fondati sull’analisi della tonometria arteriosa periferica (Figura 1).
Sensori meccano-acustici transcutanei
I sensori meccano-acustici transcutanei sono sensori wireless posizionabili nella regione sovrasternale, che attraverso processi di accelerometria triassiale permettono di registrare segnali meccano-acustici derivati dall’attività dell’apparato cardiocircolatorio e respiratorio. Integrati con tecnologie di machine learning, permettono di valutare frequenza cardiaca (FC) e frequenza respiratoria (FR) in relazione al movimento corporeo, in modo non invasivo e automatizzato5.
Dispositivi PTT
I dispositivi PTT permettono invece di registrare il tempo intercorrente tra la generazione dell’onda R all’ECG e la rilevazione dell’onda del polso in periferia. Studi clinici condotti su adulti con DRS hanno documentato l’elevata sensibilità e specificità di tale metodica, risultata in particolare più sensibile nel rilevare gli arousals rispetto all’EEG per quanto riguarda gli eventi ostruttivi6.
Raccolta dati e medicina di precisione. La rilevazione wireless dei dati acustici del sistema cardiovascolare e respiratorio
Altri dispositivi indossabili, posizionabili a livello cervicale, si fondano sulla rilevazione di dati acustici originati dal sistema cardiovascolare e respiratorio. Tali dati vengono elaborati da un algoritmo che permette di differenziare apnee e ipopnee sia ostruttive che centrali. Studi condotti su adulti con DRS hanno evidenziato una elevata accuratezza diagnostica in termini sia di sensibilità che di specificità, con costi inferiori rispetto alla tradizionale PSG7.
Esistono altri sensori wireless indossabili, collocati sul mento, che rilevano i movimenti mandibolari come marker surrogato dello sforzo respiratorio, derivandone un indice di disturbo respiratorio detto RDI. Sensori di questo tipo possono rappresentare un valido supporto diagnostico nella identificazione di micro-arousals che potrebbero non essere evidenziabili all’EEG, generando report automatizzati vantaggiosamente time-sparing rispetto all’analisi manuale di dati polisonnografici8.
Infine, esistono dispositivi, posizionati contemporaneamente al torace, al polso e al dito indice, permettono di valutare la vasocostrizione periferica e l’aumento della FC che si verificano contestualmente a un evento di apnea/ipopnea, attraverso la rilevazione della variazione di segnale di tonometria arteriosa periferica (PAT) all’indice. Studi preliminari condotti su adulti con DRS hanno documentato un’ottima correlazione tra i dati ottenuti, confrontati con PSG. Anche in ambito pediatrico, uno studio condotto su adolescenti sembra confermare la validità di tali dispositivi per rilevare eventi respiratori, con buona correlazione tra PAT e AHI e PAT e SpO2 media.
Tuttavia, le ridotte dimensioni del dispositivo ne controindicano l’utilizzo prima dei 5-6 anni di età9. Ulteriori studi sono necessari per accertare la validità di tali metodiche in Pediatria.
Sleep-omics e identificazione di fenotipi. La diagnostica dei DRS in Pediatria dopodomani: Prospettive terapeutiche personalizzate
Grazie ad algoritmi di machine learning, è oggi possibile analizzare enormi dataset derivanti dai monitoraggi notturni, con la possibilità di identificare pattern che combinino specifici dati fisiologici con determinate caratteristiche genetiche e/o demografiche. In questo contesto, l’analisi integrata di dati multidimensionali potrebbe permettere la definizione di endotipi/fenotipi DRS (“sleep-omics”)7, con la possibilità di derivarne approcci terapeutici personalizzati in grado di adattarsi alle specifiche esigenze di ciascun paziente.
Conclusioni
Negli ultimi 25 anni, l’evoluzione tecnologica ha portato significativi miglioramenti nella diagnosi dei DRS in Pediatria. Nonostante il ruolo consolidato della PSG come standard diagnostico, le numerose limitazioni di tale procedura hanno aperto la strada a metodiche alternative di più facile esecuzione quali la poligrafia domiciliare e la pulsossimetria notturna. La combinazione di nuovi dispositivi indossabili, nuove tecnologie AI e grandi dataset multicentrici offre nuove prospettive per una diagnosi sempre più precisa, rapida e personalizzata dei DRS, con conseguente riduzione dei costi sanitari, maggior accesso alle cure e miglioramento della salute e della qualità di vita dei piccoli pazienti con DRS.
Bibliografia
- Lumeng JC, Chervin RD. Epidemiology of pediatric obstructive sleep apnea. Proc Am Thorac Soc. 2008 Feb 15;5(2):242-52. doi: 10.1513/pats.200708-135MG. PMID: 18250218; PMCID: PMC2645255.
- Kaditis AG, Alonso Alvarez ML, Boudewyns A, Alexopoulos EI, Ersu R, Joosten K, Larramona H, Miano S, Narang I, Trang H, Tsaoussoglou M, Vandenbussche N, Villa MP, Van Waardenburg D, Weber S, Verhulst S. Obstructive sleep disordered breathing in 2- to 18-year-old children: diagnosis and management. Eur Respir J. 2016 Jan;47(1):69-94. doi: 10.1183/13993003.00385-2015. Epub 2015 Nov 5. PMID: 26541535.
- Garde AJB, Gibson NA, Samuels MP, Evans HJ. Recent advances in paediatric sleep disordered breathing. Breathe (Sheff). 2022 Sep;18(3):220151. doi: 10.1183/20734735.0151-2022. Epub 2022 Oct 11. PMID: 36340818; PMCID: PMC9584598.
- Bragazzi NL, Guglielmi O, Garbarino S. SleepOMICS: How Big Data Can Revolutionize Sleep Science. Int J Environ Res Public Health. 2019 Jan 21;16(2):291. doi: 10.3390/ijerph16020291. PMID: 30669659; PMCID: PMC6351921.
- Lee K, Ni X, Lee JY, Arafa H, Pe DJ, Xu S, Avila R, Irie M, Lee JH, Easterlin RL, Kim DH, Chung HU, Olabisi OO, Getaneh S, Chung E, Hill M, Bell J, Jang H, Liu C, Park JB, Kim J, Kim SB, Mehta S, Pharr M, Tzavelis A, Reeder JT, Huang I, Deng Y, Xie Z, Davies CR, Huang Y, Rogers JA. Mechano-acoustic sensing of physiological processes and body motions via a soft wireless device placed at the suprasternal notch. Nat Biomed Eng. 2020 Feb;4(2):148-158. doi: 10.1038/s41551-019-0480-6. Epub 2019 Nov 25. PMID: 31768002; PMCID: PMC7035153.
- Katz ES, Lutz J, Black C, Marcus CL. Pulse transit time as a measure of arousal and respiratory effort in children with sleep-disordered breathing. Pediatr Res. 2003 Apr;53(4):580-8. doi: 10.1203/01.PDR.0000057206.14698.47. Epub 2003 Feb 5. PMID: 12612196.
- Vennard H, Buchan E, Davies P, Gibson N, Lowe D, Langley R. Paediatric sleep diagnostics in the 21st century: the era of “sleep-omics”? Eur Respir Rev. 2024 Jun 26;33(172):240041. doi: 10.1183/16000617.0041-2024. PMID: 38925792; PMCID: PMC11216690.
- Martinot JB, Senny F, Denison S, Cuthbert V, Gueulette E, Guénard H, Pépin JL. Mandibular movements identify respiratory effort in pediatric obstructive sleep apnea. J Clin Sleep Med. 2015 Apr 15;11(5):567-74. doi: 10.5664/jcsm.4706. PMID: 25766710; PMCID: PMC4410931.
- Serra A, Cocuzza S, Maiolino L, Abramo A, Spinato G, Tonoli G, Amadori M, Politi D, Tirelli G, Spinato R, Di Mauro P. The watch-pat in pediatrics sleep disordered breathing: Pilot study on children with negative nocturnal pulse oximetry. Int J Pediatr Otorhinolaryngol. 2017 Jun;97:245-250. doi: 10.1016/j.ijporl.2017.04.021. Epub 2017 Apr 17. PMID: 28483245.
No metadata found.